Que vírus é o Bagaza?
 O vírus Bagaza (BAGV) é um vírus com invólucro, de simetria icosaédrica, com cerca de 50 nm de diâmetro (500 mil vezes mais pequeno que 1 milímetro). O seu genoma é constituído por uma única molécula de RNA de cadeia simples, linear, com cerca de 11,000 nucleótidos.
O vírus Bagaza (BAGV) é um vírus com invólucro, de simetria icosaédrica, com cerca de 50 nm de diâmetro (500 mil vezes mais pequeno que 1 milímetro). O seu genoma é constituído por uma única molécula de RNA de cadeia simples, linear, com cerca de 11,000 nucleótidos.
O BAGV inclui-se num grupo de vírus transmitidos por mosquitos, pertencente ao género Flavivirus, família Flaviviridae, ao qual pertencem também os vírus do Nilo Ocidental, do Dengue, de Zika, da Encefalite Japonesa ou da Febre Amarela, entre muitos outros menos conhecidos do público em geral, que causam quadros de encefalite em humanos. O BAGV, à semelhança de outros flavivírus, é pois potencialmente zoonótico., i.e., pode infetar humanos. A análise do genoma do BAGV revelou elevada similaridade com o vírus da meningoencefalomielite dos perus (ITV, do inglês, Israel Turkey Meningoencephalomyelitis Virus), isolado em Israel e na África do Sul em perus com doença neuroparalítica grave. Esta semelhança levou alguns autores a proporem a inclusão do BAGV na mesma espécie do ITV, ainda que, até à data, estes dois vírus continuem a ser considerados duas espécies distintas pelo Comité Internacional de Taxonomia dos Vírus (ICTV2021).
QUE ESPÉCIES SÃO AFETADAS POR ESTE VÍRUS E
QUE DOENÇA CAUSA?
 Algumas espécies de aves selvagens, como a perdiz-vermelha (Alectoris rufa), o faisão-comum (Phasianus colchicus) e o pombo-torcaz (Columba palumbus) são suscetíveis à infeção pelo BAGV, desenvolvendo quadros clínicos caracterizados por perda de peso, fraqueza, apatia e sinais neurológicos, como incoordenação motora e cegueira aparente. De todas as espécies que atualmente se sabem ser suscetíveis à infeção por BAGV, as manifestações neurológicas são mais frequentes nas perdizes, observando-se em menor grau nos faisões e raramente no pombo-torcaz.
Algumas espécies de aves selvagens, como a perdiz-vermelha (Alectoris rufa), o faisão-comum (Phasianus colchicus) e o pombo-torcaz (Columba palumbus) são suscetíveis à infeção pelo BAGV, desenvolvendo quadros clínicos caracterizados por perda de peso, fraqueza, apatia e sinais neurológicos, como incoordenação motora e cegueira aparente. De todas as espécies que atualmente se sabem ser suscetíveis à infeção por BAGV, as manifestações neurológicas são mais frequentes nas perdizes, observando-se em menor grau nos faisões e raramente no pombo-torcaz.
O exame macroscópico das perdizes vitimadas pela doença revelou extensos depósitos de pigmento de ferro no fígado e no baço (hemossiderose), resultantes da degradação da hemoglobina dos glóbulos vermelhos, estando ausentes nos faisões e sendo pouco evidentes nos pombos. A deteção do BAGV nas células endoteliais que revestem as artérias, veias e capilares de vários órgãos é apenas observada em perdiz-vermelha, justificando também a severidade da doença nesta espécie.
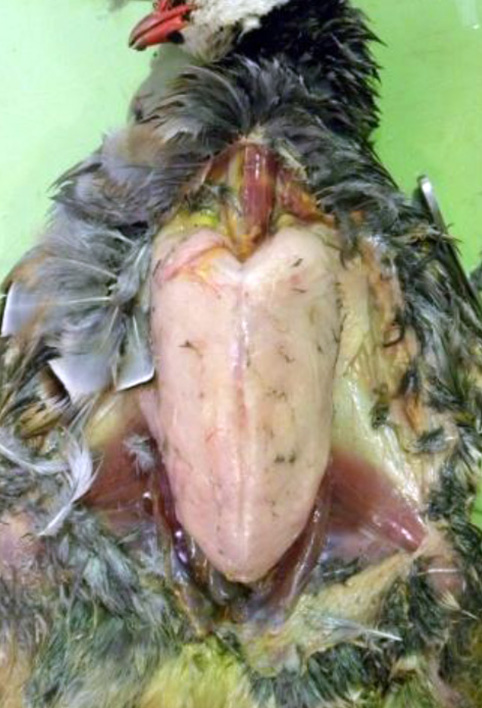
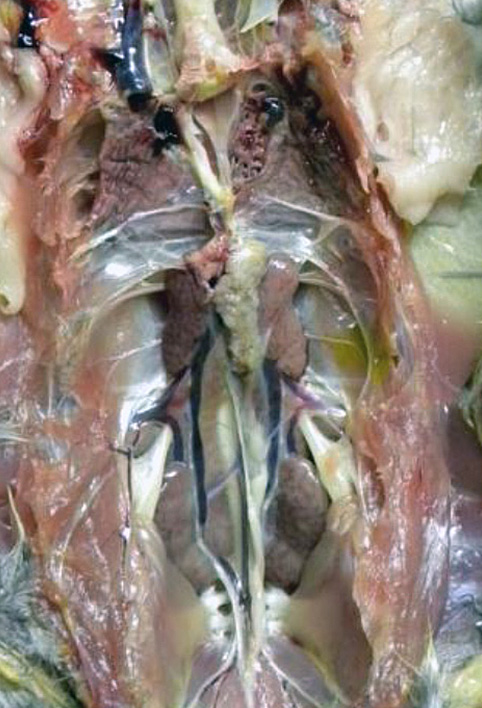
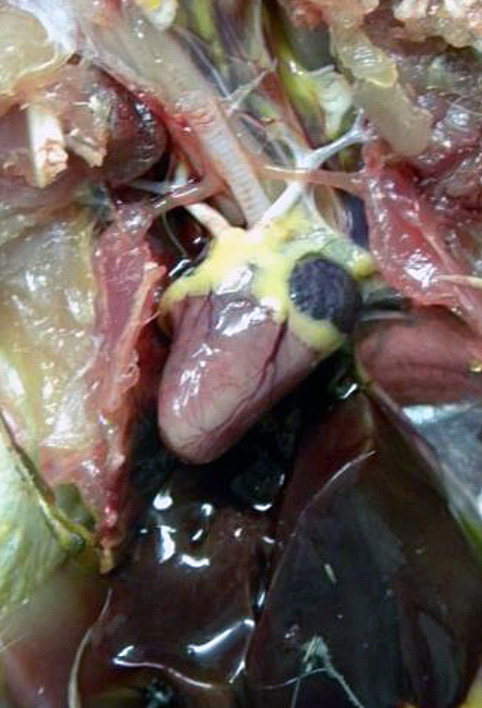
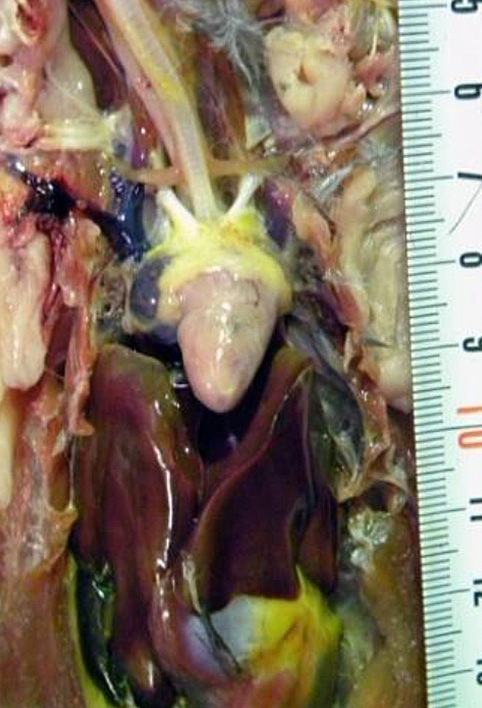
A taxa de mortalidade por BAGV em perdizes foi estimada em 23% e nos faisões em cerca de 11% [1], tendo conduzido, contudo, a uma redução de 86% da perdiz-vermelha e de 30% do faisão-comum no sudoeste de Espanha, em 2010 [2].
A suscetibilidade do Homem à infeção foi evidenciada pela deteção de anticorpos neutralizantes contra o BAGV no sangue de pacientes da Índia que apresentavam encefalite, demonstrando a capacidade deste vírus infetar humanos e sugerindo uma possível relação com os quadros clínicos desenvolvidos,. Foram também detetados anticorpos em indivíduos assintomáticos (sem sintomas), indicando infeção subclínica nestes indivíduos [3].
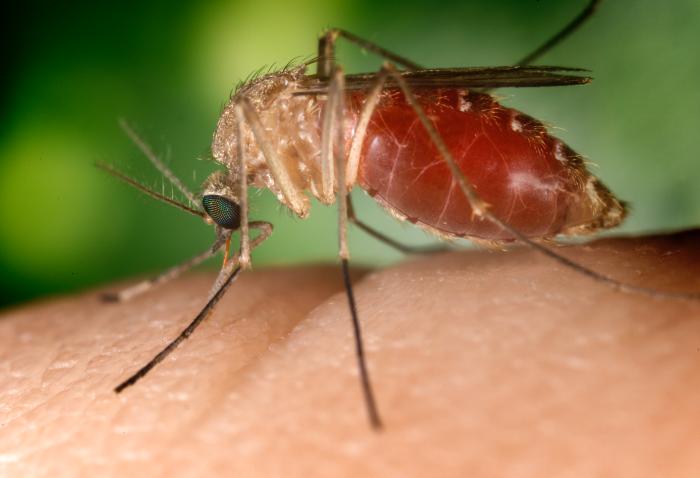
COMO SE TRANSMITE A INFEÇÃO AOS ANIMAIS E AO HOMEM?
O BAGV transmite-se pela picada de mosquitos pertencentes aos géneros Culex spp. (comprovadamente as espécies Culex tritaeniorhynchus, Culex quinquefasciatus, Culex univittatus) e Aedes (Aedes aegypti). Nos vetores competentes, que podem incluir outras espécies ainda não identificadas, o vírus multiplica-se atingindo títulos elevados, sendo subsequentemente transmitido às aves ou a pessoas, durante a alimentação dos mosquitos fêmeas (apenas as fêmeas são hematófagas, ou seja, alimentam-se de sangue). No entanto, a transmissão sem intervenção de vetores, i.e., por contacto direto entre perdizes infetadas, ou indiretamente através de materiais contaminados foi demostrada em ensaios de experimentação animal [4].
QUANDO FOI IDENTIFICADO PELA PRIMEIRA VEZ NO MUNDO E NA EUROPA?
O vírus Bagaza foi identificado pela primeira vez em 1966 em mosquitos fêmea do género Culex spp., recolhidos no distrito de Bagaza, na República Centro-Africana [5], tendo sido posteriormente também reportado em mosquitos em outras regiões de África, nomeadamente no Senegal e na Mauritânia, na Índia e na Península Arábica. Só muito mais tarde, em 2010, o BAGV foi isolado de vertebrados, nomeadamente perdizes e faisões durante um surto ocorrido no sul de Espanha, em Cádiz [6]. Desde então, a doença não voltou a ser oficialmente reportada em Espanha, ou em qualquer outro país da Europa, embora existam novamente relatos de mortalidade elevada em perdizes no sul de Espanha desde setembro de 2021 (https://www.club-caza.com/actualidad/actualver.asp?nn=14150).
O DIAGNÓSTICO LABORATORIAL OFICIAL DE BAGV EM PORTUGAL
A confirmação laboratorial do BAGV em Portugal foi efetuada recentemente no Laboratório de Virologia do Instituto Nacional de Investigação Agrária e Veterinária (INIAV, I.P.), Laboratório Nacional de Referência para as Doenças dos Animais, em dois cadáveres de perdiz-vermelha, recolhidos no campo a 9 de outubro 2021 em Serpa, e entregues por uma Organização do Setor da Caça, com indicação de alterações neurológicas.
Estes animais foram investigados para a presença de vírus que afetam o Sistema Nervoso Central, como o vírus da doença de Newcastle (NDV), os flavivírus Usutu, BAGV, e o vírus do Nilo Ocidental (WNV), este último já detetado no nosso país em aves e equinos, pelo menos desde 2010 [7-9] e em humanos em 2004 [10, 11].
Os materiais biológicos recolhidos foram manipulados em condições de biossegurança de nível 3 (BSL-3) dado o potencial zoonótico destes agentes. A pesquisa de WNV, BAGV, vírus Usutu e NDV nas perdizes rececionadas no INIAV, foi efetuada a partir de amostras de cérebro, coração, rim e intestino das aves, por PCR em tempo real (RT-qPCR), através de métodos de deteção específicos para cada um dos agentes investigados [12-15].
Os resultados obtidos comprovaram a presença do BAGV nos órgãos das duas aves e a ausência dos restantes vírus. Subsequentemente, foi sequenciada uma região genómica diferente da que é alvo do sistema de diagnóstico por RT-qPCR, obtida por um método de PCR convencional desenvolvido no INIAV. A análise da sequência do BAGV agora detetado em Portugal revelou a elevada semelhança nucleotídica e filogenética com um grupo de vírus que inclui o BAGV responsável pelo surto de Espanha em 2010 e com outros provenientes de África.
Os dados recolhidos durante a necropsia mostraram alterações macroscópicas nomeadamente a descoloração do miocárdio, que correspondem microscopicamente a lesões de miocardite por infiltração linfoplasmocitária multifocal.

Laboratório de nível de biossegurança 3 (BSL-3) do Laboratório de Virologia do INIAV, I.P

Deteção de BAGV por RT-PCR em tempo real

Extração de ácidos nucleicos virais no Laboratório de Virologia do INIAV
QUAIS OS RISCOS ASSOCIADOS À MANIPULAÇÃO OU CONTACTO DE ANIMAIS INFETADOS?
Uma vez que esta doença se transmite principalmente por picada de mosquito, o contacto direto com os animais infetados não apresenta um risco muito elevado de contágio. No entanto, o contacto direto com feridas abertas ou a inalação de partículas virais pode potenciar o risco de infeção.
Muito embora os dados atualmente disponíveis sobre o impacto clínico da infeção por BAGV em humanos sejam muito limitados, o potencial zoonótico deste vírus bem como de outros flavivírus neurotrópicos (que afetam o sistema nervoso) requer a manipulação criteriosa das aves infetadas e dos materiais biológicos no seu processamento para diagnóstico.
HÁ RISCO DA INFEÇÃO SE TORNAR ENDÉMICA EM PORTUGAL?
Até agora, a deteção muito esporádica do BAGV na Europa sugere que a sua introdução resulta de eventos ocasionais, provavelmente relacionados com a migração de aves infetadas a partir do Norte de África, à semelhança do que se verificou com surtos causados por outros flavivírus, como por exemplo o WNV. Portugal faz parte do corredor migratório Atlântico-Leste e para muitas espécies de aves Europeias é um importante refúgio de inverno, enquanto para outras, é um posto de abastecimento vital nas suas longas viagens Norte-Sul [16].
A persistência da doença em território nacional dependerá da existência e distribuição de vetores competentes que assegurem a transmissão do vírus, da existência de micro-habitats onde o vetor perdure ou da persistência do BAGV em espécies suscetíveis nos períodos do ano em que os vetores não estão ativos (no inverno).
É por isso pouco provável que, num futuro imediato a doença se torne endémica em Portugal. No entanto, as alterações climáticas têm vindo a favorecer a introdução de espécies de mosquito invasoras competentes para a multiplicação do BAGV. Os dados sobre a diversidade de espécies de mosquitos presentes em Portugal são aferidos anualmente pela rede REVIVE (CEVDI, Instituto Nacional de Saúde Doutor Ricardo Jorge). De acordo com esta rede, o mosquito Culex univittatus, de onde o BAGV já foi isolado como referido anteriormente, é uma espécie existente em Portugal, tendo também já sido demonstrada a sua competência enquanto vetor de WNV. O Aedes aegypti, também vetor do BAGV, está presente na Região Autónoma da Madeira desde 2005 e, tal como o Aedes albopictus, que foi identificado na região norte de Portugal em 2017 e no Algarve em 2018, é também vetor de Dengue, Zika e Chikungunya (um vírus pertencente a outra família, nomeadamente à família Togaviridae, género Alphavirus), e que têm vindo a aumentar a sua distribuição geográfica.
| Existem por isso em Portugal condições favoráveis no que toca à presença de espécies de mosquitos competentes para a multiplicação e transmissão do BAGV, o que pode favorecer a reemergência ou a reintrodução e persistência da infeção no futuro, tanto no continente como na Ilha da Madeira, onde a população de perdizes é elevada. |
QUAIS SÃO AS RECOMENDAÇÕES PARA AS
ZONAS DE CAÇA AFETADAS PELA DOENÇA?
- Evitar realizar repovoamentos de perdiz-vermelha e faisão-comum, com aves de estatuto sanitário desconhecido, uma vez que destes pode resultar a introdução do vírus na zona de caça e o consequente aumento da densidade das aves favorecer a disseminação da doença;
- Reduzir a concentração de animais nos comedouros e bebedouros eliminando-os ou dispersando-os geograficamente;
- Manter bebedouros, comedouros e, se possível, charcas de água sempre limpos;
- Evitar águas estagnadas em equipamentos onde os mosquitos possam fazer a sua criação (ex. pneus, baldes);
- Vigiar ativamente a ocorrência de sintomatologia compatível (incoordenação motora, cegueira aparente) em aves, e informar os serviços locais da Direção Geral de Alimentação e Veterinária (DGAV) ou do Instituto da Conservação da Natureza e das Florestas (ICNF);
- Caso seja encontrado um animal com sintomatologia compatível com BAGV, reencaminhá-lo para o Laboratório de Referência Nacional (INIAV, I.P.) para diagnóstico;
- Notificar eventos de mortalidade em perdizes, faisões ou pombos através da Aplicação de Notificação Imediata da Mortalidade de Animais Selvagens (ANIMAS).
IMPORTÂNCIA DO DIAGNÓSTICO LABORATORIAL OFICIAL E DA COMUNICAÇÃO DA DOENÇA À AUTORIDADE VETERINÁRIA NACIONAL (DGAV) E À DIREÇÃO GERAL DE SAÚDE (DGS)
É importante confirmar as suspeitas de infeção por BAGV através de diagnóstico laboratorial. Sendo um vírus emergente (i.e., que o país não tem, ou desconhece ter) e com potencial zoonótico (podendo constituir um problema de Saúde Pública), os casos positivos são reportados à DGAV, que por sua vez os reporta à DGS. Este sistema de alerta permite sensibilizar a classe médica para a possibilidade da existência desta doença em humanos.
Por outro lado, a confirmação da suspeita clínica por exames laboratoriais permite obter dados sanitários oficiais que representem a situação real do País e sustentem eventuais medidas de intervenção que possam vir a ter de ser implementadas.
PARA ONDE ENVIAR MATERIAL PARA
DIAGNÓSTICO DE BAGV?
Recomenda-se o envio de penas, aves doentes ou de cadáveres em bom estado de conservação para o Laboratório de Virologia do INIAV, I.P.
O material enviado deve ser acompanhado de uma Folha de Requisição de Análises, disponível para download aqui, onde deve constar o local e data do achado, um contacto para notificação do resultado do teste, e os restantes elementos solicitados.
Qualquer informação de carácter epidemiológico deve também ser providenciada (ex. se houver mais mortes, se observou animais moribundos, se, e quando, foi feito algum repovoamento, etc).
QUAL O PROCEDIMENTO DE COLHEITA DE CADÁVERES?
- Recolher o cadáver para um saco de plástico sem o tocar com a mão nua, com recurso a uma luva ou a um outro saco que a substitui;
- Preencher o modelo de Requisição de Análise;
- Fechar o saco onde o cadáver foi introduzido com um nó;
- Introduzir, o saco com o cadáver, o modelo de requisição de análise dobrado em 4, e a luva (ou saco) utilizada para pegar no animal (invertida, com parte suja para dentro), num segundo saco e fechá-lo com um nó;
- Desinfetar sempre as mãos após a manipulação dos cadáveres;
-
1.Entregar o material no INIAV I.P. (edifício sede em Oeiras).
Qual o procedimento de colheita de material biológico em vida para Diagnóstico de BAGV?
 O diagnóstico de BAGV em vida pode ser efetuado a partir de penas de crescimento (penas imaturas), uma vez que as cargas virais mais elevadas nos animais infetados por BAGV se registam nos folículos de penas imaturas.
O diagnóstico de BAGV em vida pode ser efetuado a partir de penas de crescimento (penas imaturas), uma vez que as cargas virais mais elevadas nos animais infetados por BAGV se registam nos folículos de penas imaturas.
- Recolher algumas (10) penas imaturas da zona acima da cauda, usando uma luva ou um saco para proteger a mão;
- Preencher o modelo de Requisição de Análise;
- Colocar as penas num saco de plástico;
- Colocar o saco com as penas num segundo saco, juntamente com o modelo de requisição de análise dobrado em 4, e a luva (ou saco) utilizada para pegar no animal (invertida, com parte suja para dentro), e fechá-lo com um nó;
- Desinfetar sempre as mãos após a manipulação dos animais.
- Entregar o material no INIAV I.P. (edifício sede em Oeiras).
LOCAL DE ENTREGA DOS CADÁVERES OU AVES MORIBUNDAS PARA A REALIZAÇÃO DE DIAGNÓSTICO DE BAGV NO INIAV I.P.?
O Laboratório de Virologia (Laboratório Nacional de Referência para as doenças dos animais), está localizado no Polo de Invação de Oeiras do INIAV, I.P. (edificio sede), dispondo de um Laboratório de Alta Segurança (Nível 3) para manipulação de agentes infeciosos perigosos para os animais, como por exemplo: o vírus da Peste Suína Africana, o vírus da Raiva, o vírus da Gripe ou o SARS-CoV-2...
A entrega dos cadáveres ou de penas, pode ser feita em:
- INIAV, I.P. - Laboratório de Virologia
Av. da República, Quinta do Marquês
2780-157 Oeiras, Portugal
COMO CONSERVAR O MATERIAL ATÉ AO SEU ENVIO PARA O LABORATÓRIO?
Se não for possível a sua entrega imediata, o cadáver deve ser mantido refrigerado (até 3 dias) ou congelado até à sua entrega e deve ser transportado em caixa térmica com acumuladores de frio.
As penas podem ser conservadas sob refrigeração até ao seu envio.
QUAL O CUSTO DAS ANÁLISES NO INIAV I.P.?
A DGAV e o INIAV estabeleceram um protocolo de colaboração para aprofundar o conhecimento sobre a disseminação do vírus Bagaza nas populações de aves cinegéticas. Após receção da notificação de mortalidade, as aves mortas poderão ser elegíveis para este protocolo, sendo o custo da análise suportado por aquelas entidades. Caso contrário, ou quando terminar a vigência do referido protocolo, o preço da necropsia dos animais é de 5€ + IVA e da análise virológica de 30€ + IVA. O tempo de resposta é de 5 dias úteis.
QUAL A ATUAÇÃO DAS ENTIDADES OFICIAIS PORTUGUESAS FACE A ESTE NOVO VÍRUS?
A DGAV, o INIAV e o ICNF estão a trabalhar em conjunto no sentido de proceder a uma investigação de campo com vista a aprofundar a dispersão do vírus e, consequentemente elaborar as medidas a serem adotadas futuramente.
|
BIBLIOGRAFIA
|















